恩朗苏拜单抗获批,开启宫颈癌免疫治疗新篇章
发布时间:2024-07-02|
作者:石药集团
2024年6月25日,由石药集团自主研发的1类生物新药、PD-1抑制剂恩朗苏拜单抗注射液(恩舒幸®)正式获得国家药品监督管理局的批准,此次获批的适应症为:既往接受含铂化疗治疗失败的PD-L1表达阳性(CPS≥1)的复发或转移性宫颈癌患者。


在世界范围内,宫颈癌已成为女性第四大常见恶性肿瘤,其发病率和死亡率均处于妇科恶性肿瘤前列,并呈现年轻化趋势。宫颈癌的预后与临床分期密切相关,复发或转移性宫颈癌标准治疗预后较差,5年生存率仅约17%。故亟需探索新的临床治疗方式以延长患者的总生存期。目前恩朗苏拜单抗研究结果显示了良好的疗效,为未来宫颈癌的临床治疗提供有意义的思路和方向。
恩朗苏拜单抗(恩舒幸®)是 IgG4 亚型抗 PD-1 全人源单抗。荣获由国家知识产权局颁发的发明专利证书。作为IgG4亚型,恩朗苏拜单抗可降低ADCC和CDC效应,通过与T细胞表面的PD-1分子结合,进而阻断PD-1/PD-L1通路对T细胞的抑制作用,使T细胞重新成为英勇的战士,显著发挥抗肿瘤作用。
一类新药,三重创新,恩朗苏拜单抗构效优势带来安全性及有效性平衡获益
恩朗苏拜单抗通过分子构型的创新性改造,使其焕发持久、安全、增效的三重创新优势:
一、通过改造轻链CDR2和CDR3,提高PD-1识别率,使得PD-1占位达95%以上;通过改造重链CDR1和CDR3,增加抗体与PD-1亲和力至皮摩尔级别,使其与PD-1结合更紧密,解离速度更缓慢,从而实现更持久的阻断效果;
二、优化抗体的 Fc 段,消除了抗体和补体依赖的细胞毒作用,避免了效应 T 细胞耗损,降低免疫相关不良反应;精准调控半衰期达到5.76天,药物在体内无明显蓄积,降低免疫原性,合理的平衡了有效性和安全性使其在达到显著药效的同时表现出极佳的安全性。
三、优化抗体 Fab 段,使其与 PD-1 的结合更紧密,增强免疫治疗疗效。

恩朗苏拜单抗三重创新带来Ⅰ-Ⅲ临床研究多效获益:
一、恩朗苏拜单抗的Ⅰb期队列B扩展研究,是一项单臂、开放、多中心的Ⅰb期临床研究,目的是评价恩朗苏拜单抗在≥2线复发或转移性宫颈癌中的安全性和有效性。
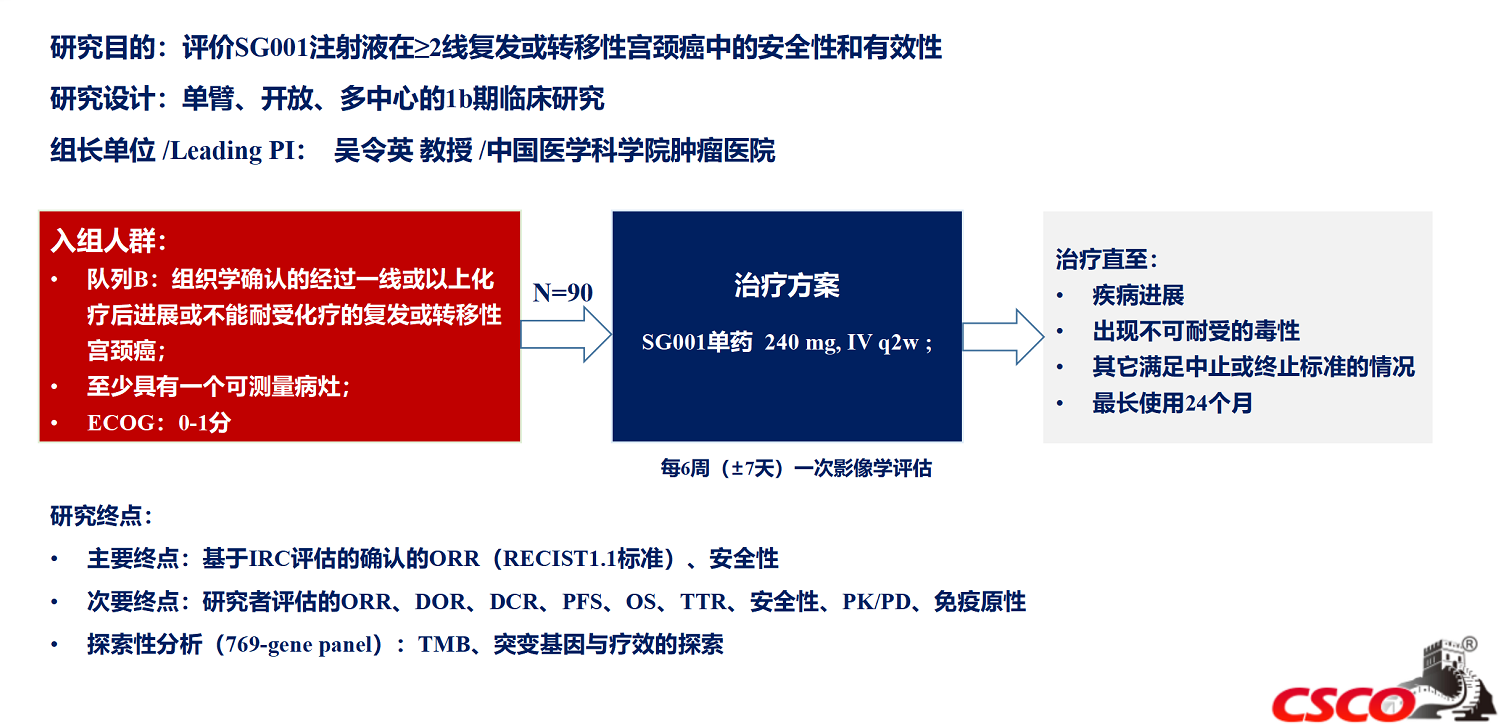
研究结果显示,ORR达25.3%,DCR 67%。探索性分析显示,在PD-L1阳性人群中,ORR达30.2%。另外,中位PFS达5.5个月,12个月OS率达67.2%,12个月DoR率为64.8%。恩朗苏拜单抗Ⅰ期研究结果已在2022年CSCO大会中公布,其优异的疗效数据引起了广大医生的关注。
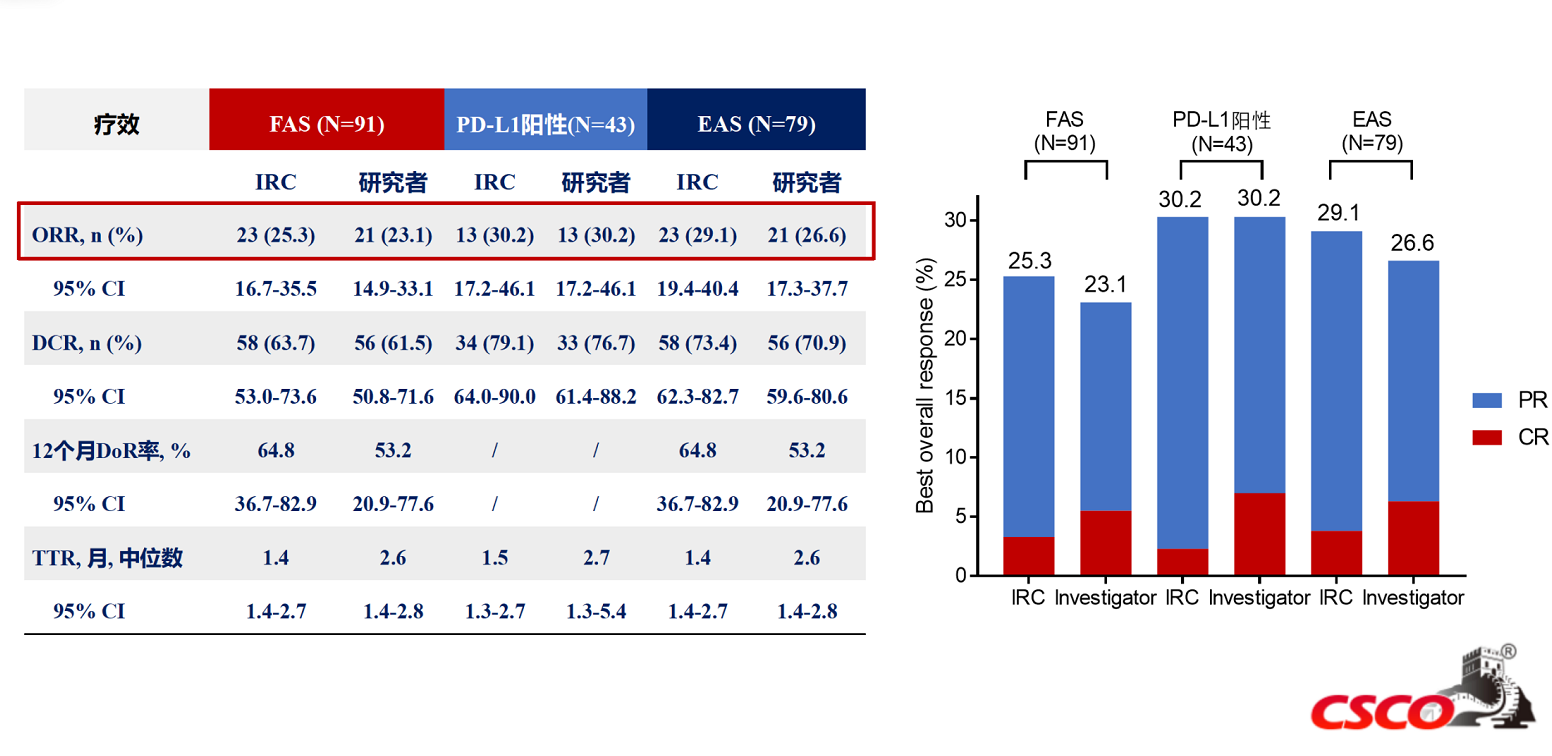
二、恩朗苏拜单抗的Ⅱ期临床研究是一项单臂、多中心的临床研究,旨在评价恩朗苏拜单抗治疗PD-L1表达阳性的复发或转移性宫颈癌患者的安全性和有效性。研究共纳入107例PD-L1阳性、复发或转移性宫颈癌患者。主要研究终点:独立评审委员会(IRC)根据RECIST1.1版评估的客观缓解率(ORR)。
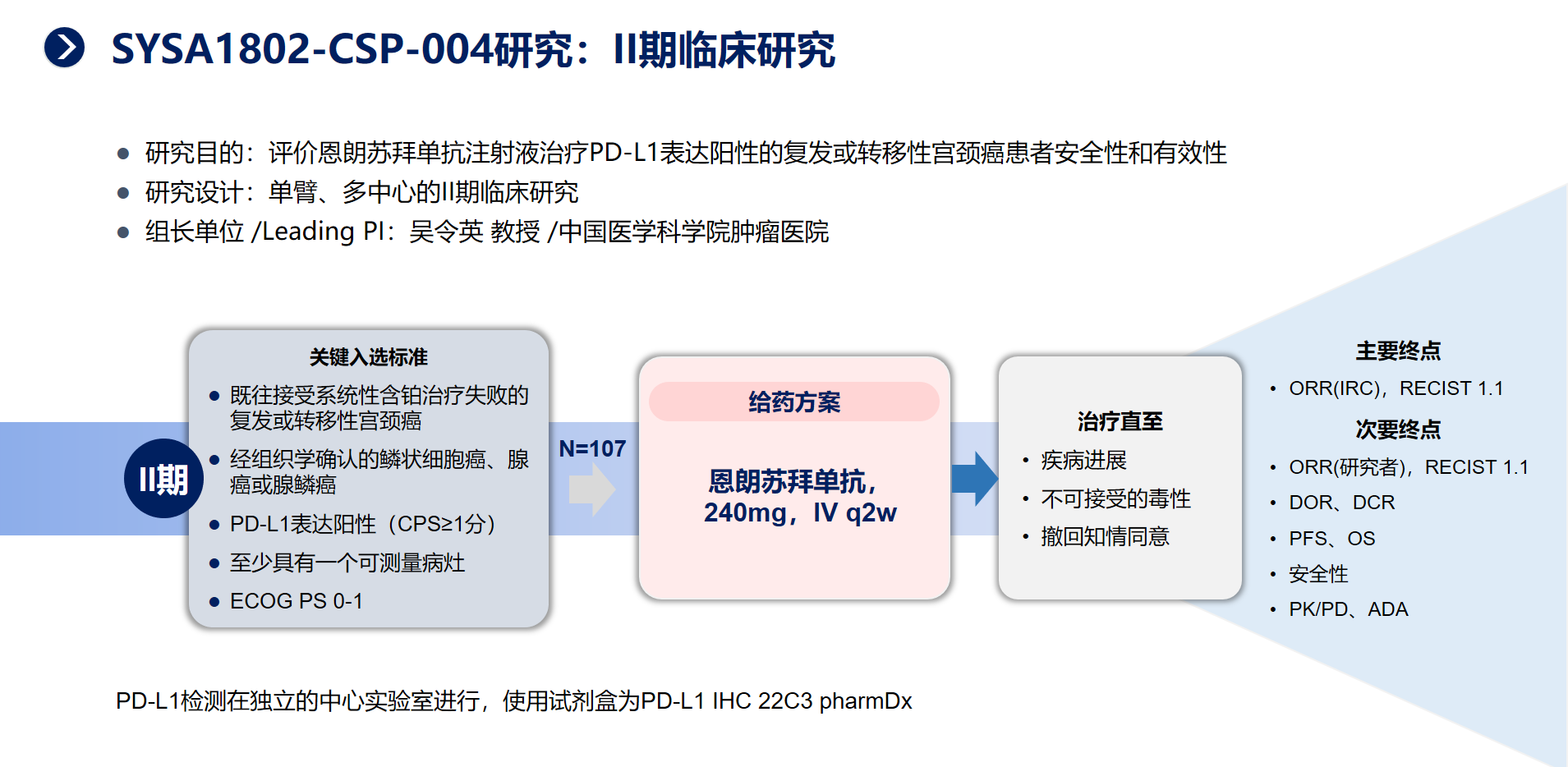
研究结果显示,恩朗苏拜单抗单药治疗既往经过至少一线含铂化疗失败的PD-L1阳性复发或转移性宫颈癌,ORR高达29%,揭示了恩朗苏拜单抗显著的抗肿瘤活性。另外,DCR为54.2%,中位PFS达3.06个月,OS数据尚未达到,仍在持续随访中。预估的6个月、12个月、18个月的总生存率分别为76.8%、68.4%和54.6%。安全性方面,大多数不良反应为1-2级,≥3级的治疗相关不良反应(TRAE)发生率为24.3%,无导致死亡的TRAE的发生。恩朗苏拜单抗具有良好的安全性和耐受性,未发现新的安全性信号,大多数免疫相关不良反应均可通过暂停给药、永久停药或对症治疗后得到缓解或恢复。
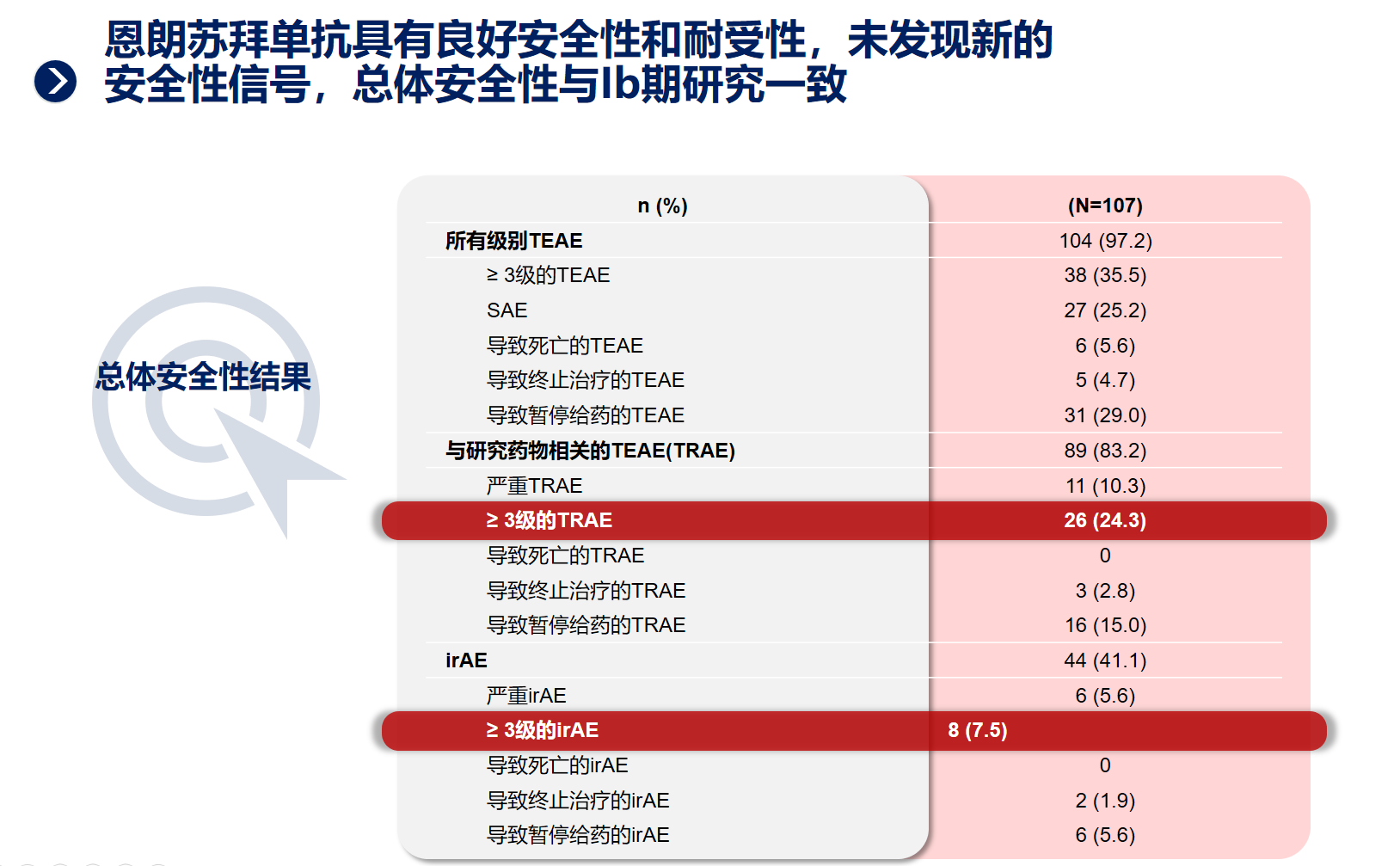
恩朗苏拜单抗Ⅱ期研究结果已在2024年ASCO大会中公布,此项临床研究的成功,意味着恩朗苏拜单抗将为更多复发或转移性宫颈癌患者的二线治疗带来更优的治疗选择。
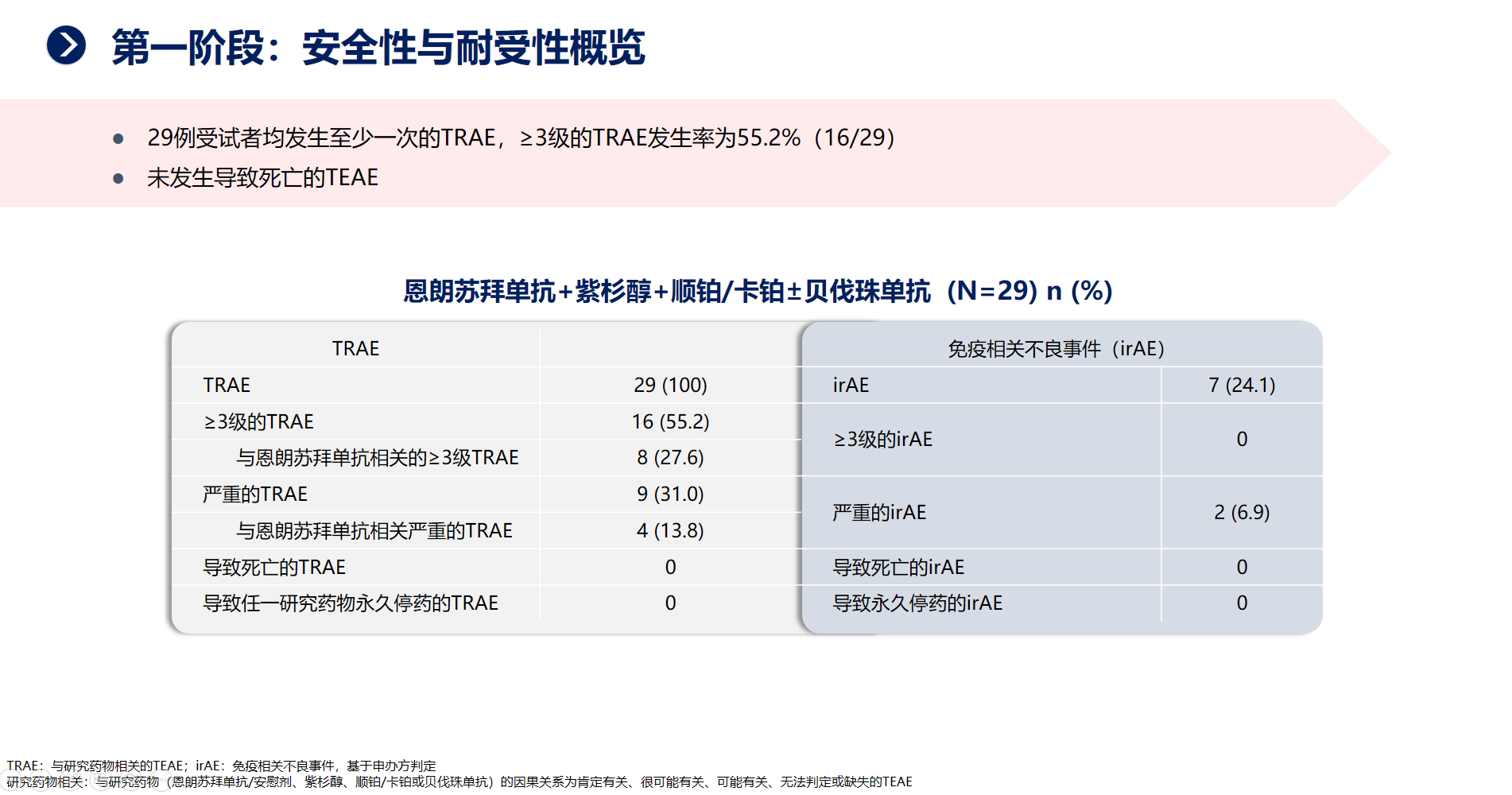
三、基于Ⅰ、Ⅱ期临床研究出色的研究结果,恩朗苏拜单抗用于不适合根治性治疗的复发或转移性宫颈癌患者的Ⅲ期研究也已正式启动。该研究计划招募368例受试者,并分为两个阶段进行。目前,已完成第一阶段的入组,共招募29例受试者,已初步评估了安全性和疗效数据。
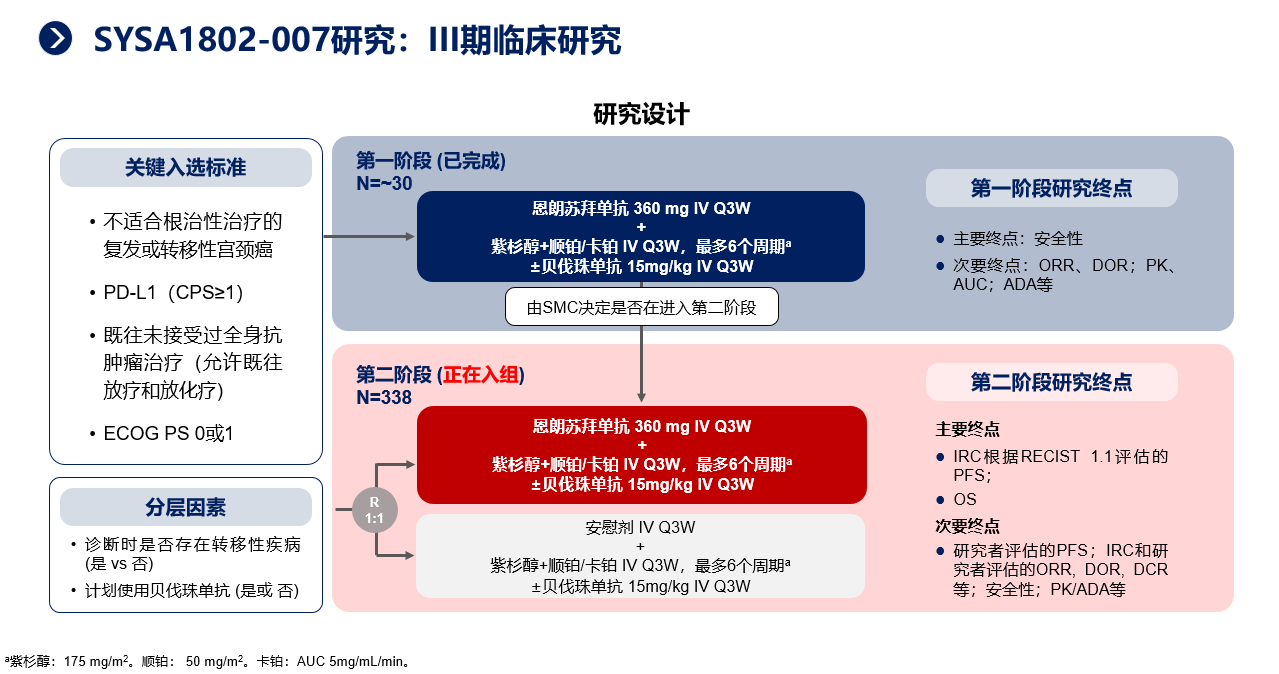
从当前的数据来看,恩朗苏拜单抗联合化疗表现出显著的疗效,ORR高达71%,安全性可控可管理。
第二阶段的入组正在进行中,预计在2025年底完成入组。根据目前的数据,恩朗苏拜单抗Ⅲ期研究的最终结果令人期待,希望能通过此项研究,为中国宫颈癌患者提供更优的一线治疗方案。也期待随着这项研究结果的公布,可以改变中国宫颈癌一线治疗的治疗策略,进而改写中国临床实践指南。


在世界范围内,宫颈癌已成为女性第四大常见恶性肿瘤,其发病率和死亡率均处于妇科恶性肿瘤前列,并呈现年轻化趋势。宫颈癌的预后与临床分期密切相关,复发或转移性宫颈癌标准治疗预后较差,5年生存率仅约17%。故亟需探索新的临床治疗方式以延长患者的总生存期。目前恩朗苏拜单抗研究结果显示了良好的疗效,为未来宫颈癌的临床治疗提供有意义的思路和方向。
恩朗苏拜单抗(恩舒幸®)是 IgG4 亚型抗 PD-1 全人源单抗。荣获由国家知识产权局颁发的发明专利证书。作为IgG4亚型,恩朗苏拜单抗可降低ADCC和CDC效应,通过与T细胞表面的PD-1分子结合,进而阻断PD-1/PD-L1通路对T细胞的抑制作用,使T细胞重新成为英勇的战士,显著发挥抗肿瘤作用。
一类新药,三重创新,恩朗苏拜单抗构效优势带来安全性及有效性平衡获益
恩朗苏拜单抗通过分子构型的创新性改造,使其焕发持久、安全、增效的三重创新优势:
一、通过改造轻链CDR2和CDR3,提高PD-1识别率,使得PD-1占位达95%以上;通过改造重链CDR1和CDR3,增加抗体与PD-1亲和力至皮摩尔级别,使其与PD-1结合更紧密,解离速度更缓慢,从而实现更持久的阻断效果;
二、优化抗体的 Fc 段,消除了抗体和补体依赖的细胞毒作用,避免了效应 T 细胞耗损,降低免疫相关不良反应;精准调控半衰期达到5.76天,药物在体内无明显蓄积,降低免疫原性,合理的平衡了有效性和安全性使其在达到显著药效的同时表现出极佳的安全性。
三、优化抗体 Fab 段,使其与 PD-1 的结合更紧密,增强免疫治疗疗效。

恩朗苏拜单抗三重创新带来Ⅰ-Ⅲ临床研究多效获益:
一、恩朗苏拜单抗的Ⅰb期队列B扩展研究,是一项单臂、开放、多中心的Ⅰb期临床研究,目的是评价恩朗苏拜单抗在≥2线复发或转移性宫颈癌中的安全性和有效性。

研究结果显示,ORR达25.3%,DCR 67%。探索性分析显示,在PD-L1阳性人群中,ORR达30.2%。另外,中位PFS达5.5个月,12个月OS率达67.2%,12个月DoR率为64.8%。恩朗苏拜单抗Ⅰ期研究结果已在2022年CSCO大会中公布,其优异的疗效数据引起了广大医生的关注。

二、恩朗苏拜单抗的Ⅱ期临床研究是一项单臂、多中心的临床研究,旨在评价恩朗苏拜单抗治疗PD-L1表达阳性的复发或转移性宫颈癌患者的安全性和有效性。研究共纳入107例PD-L1阳性、复发或转移性宫颈癌患者。主要研究终点:独立评审委员会(IRC)根据RECIST1.1版评估的客观缓解率(ORR)。

研究结果显示,恩朗苏拜单抗单药治疗既往经过至少一线含铂化疗失败的PD-L1阳性复发或转移性宫颈癌,ORR高达29%,揭示了恩朗苏拜单抗显著的抗肿瘤活性。另外,DCR为54.2%,中位PFS达3.06个月,OS数据尚未达到,仍在持续随访中。预估的6个月、12个月、18个月的总生存率分别为76.8%、68.4%和54.6%。安全性方面,大多数不良反应为1-2级,≥3级的治疗相关不良反应(TRAE)发生率为24.3%,无导致死亡的TRAE的发生。恩朗苏拜单抗具有良好的安全性和耐受性,未发现新的安全性信号,大多数免疫相关不良反应均可通过暂停给药、永久停药或对症治疗后得到缓解或恢复。

恩朗苏拜单抗Ⅱ期研究结果已在2024年ASCO大会中公布,此项临床研究的成功,意味着恩朗苏拜单抗将为更多复发或转移性宫颈癌患者的二线治疗带来更优的治疗选择。
三、基于Ⅰ、Ⅱ期临床研究出色的研究结果,恩朗苏拜单抗用于不适合根治性治疗的复发或转移性宫颈癌患者的Ⅲ期研究也已正式启动。该研究计划招募368例受试者,并分为两个阶段进行。目前,已完成第一阶段的入组,共招募29例受试者,已初步评估了安全性和疗效数据。

从当前的数据来看,恩朗苏拜单抗联合化疗表现出显著的疗效,ORR高达71%,安全性可控可管理。

第二阶段的入组正在进行中,预计在2025年底完成入组。根据目前的数据,恩朗苏拜单抗Ⅲ期研究的最终结果令人期待,希望能通过此项研究,为中国宫颈癌患者提供更优的一线治疗方案。也期待随着这项研究结果的公布,可以改变中国宫颈癌一线治疗的治疗策略,进而改写中国临床实践指南。







